Hace 60 años la genetista británica Mary Frances Lyon (1925-2014) desarrolló una hipótesis según la cual en los cromosomas sexuales de las mujeres y de las hembras de los mamíferos en general tiene lugar un peculiar proceso de inactivación que las convierte en mosaicos celulares. Esta hipótesis que desde entonces se ha conocido como lionización ha llegado plenamente vigente hasta nuestros días, habiendo propiciado interesantes avances y descubrimientos.

LA LIONIZACIÓN
Al final de los años 50 del siglo XX se había puesto de manifiesto que en los varones la pareja de cromosomas sexuales estaba constituida por un cromosoma de tamaño normal, el X heredado de la madre, y por un cromosoma muy pequeño, el Y heredado del padre. En las mujeres en cambio esta pareja estaba constituida por dos cromosomas X, uno del padre y otro de la madre. De ello se deducía que las mujeres tenían el doble de genes presentes en el cromosoma X en relación con los varones, lo que no es poco pues en el X van más de mil genes, y en el Y sólo unos 75. Se planteaba por tanto el enigma de si en las células de las hembras se expresan los genes de los dos cromosomas X, o si se compensa de alguna forma la dosis doble con respecto a la única de los varones.
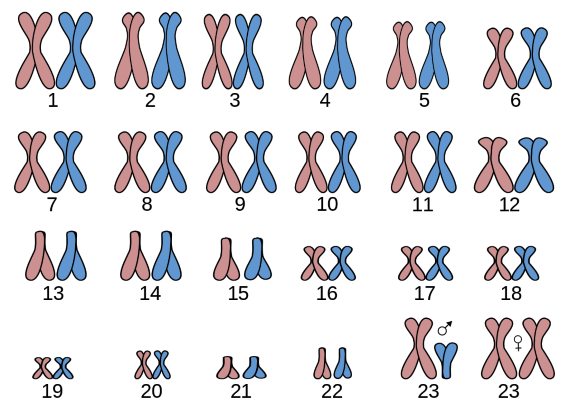
Ante este dilema, Lyon propuso en primer lugar que uno de los dos cromosomas X de las células somáticas de las mujeres-y de las hembras de los mamíferos en general- está inactivado en la fase en la que se expresan los genes, en interfase 1. Concretamente lo que sucede es que ese cromosoma X inactivado está totalmente condensado-se dice que está heterocromatinizado- mientras el otro X y el resto de los cromosomas está descondensado y expresándose en ARN y proteínas. El cromosoma X inactivado sería el origen de la llamada cromatina sexual o corpúsculo de Barr, un corpúsculo más teñido que se observaba en los núcleos de las células femeninas, lo que estaba ausente en las masculinas. Esta inactivación por heterocromatinación determinaría que las células de las hembras aunque lleven doble dosis de los genes presentes en el X sólo tengan activos los de uno-el que no está heterocromatinizado-, compensándose así su dosis doble con respecto a los varones que tienen un solo X.

En segundo lugar Lyon propuso que tal inactivación se produce en las primeras etapas del desarrollo de las hembras-de hecho a las escasas dos horas de la fecundación- y al azar: en unas células se inactiva el X de origen paterno y en otras el materno. Y en tercer lugar, defendió que una vez que se ha producido la inactivación de un cromosoma X concreto en una célula embrionaria concreta, todas las células que se originen de ella heredan tal inactivación, determinando que en la zona del cuerpo adulto a la que da lugar esa célula todas las células tengan esa inactivación. Con ello se explicaría por qué la aparición de organismos con parches para la coloración del pelaje serían hembras y no machos. Este es el caso de las gatas atigradas con parches de color naranja y negro sobre un fondo blanco. Tales gatas serían heterocigóticas para el gen que determina los colores naranja y negro estando ese gen localizado en los cromosomas X. Los parches de color reflejarían las zonas que se han originado en el desarrollo a partir de células que han inactivado uno u otro de los cromosomas X, y que por ello en unas zonas expresan uno de los alelos del color-el naranja- y en otras zonas expresan el otro-el negro.
Por lo tanto y en conclusión lo que ocurre según lo que desde entonces se ha conocido como lionización es que las hembras de los mamíferos son un mosaico que por zonas expresan los genes de uno u otro de los dos cromosomas X que portan sus células, lo que no sucede en los machos que en sus células expresan los genes de su único X, además de los del Y.
CONCEPTOS GENÉTICOS REVOLUCIONARIOS EN TORNO A LA LIONIZACIÓN
Aunque al principio hubo algunas reticencias, la propuesta de Mary Lyon sobre el funcionamiento de los cromosomas X de las mujeres y de las hembras de mamíferos en general fue aceptada en los años posteriores. Sobre todo porque en las muchas investigaciones que suscitó su hipótesis se obtuvieron contundentes pruebas de tipo genético y citológico, algunas obtenidas por ella misma, que la apoyaban. Y una vez confirmada, ha supuesto el punto de partida de diversos descubrimientos, unos con interés desde el punto de vista de la biología teórica y otros con implicaciones para la genética clínica.
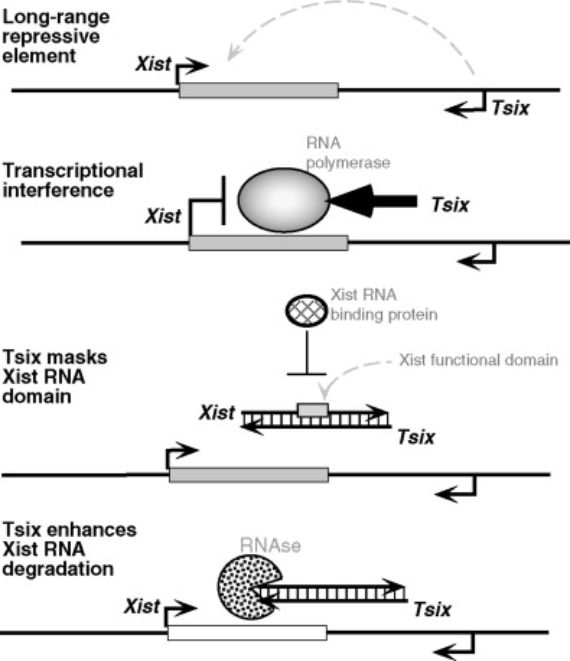
Así 30 años después del primer trabajo de Lyon sobre este mecanismo se descubrió 2 que la inactivación de uno de los dos cromosomas X de las hembras estaba controlada por el propio cromosoma X que se va a inactivar. Y que no era debida, como sucede normalmente, a una proteína que viniera de algún gen de otro cromosoma o del mismo X. Es debida a que en el cromosoma X que se va a inactivar un gen, el gen Xist- del inglés X inactive specific transcript- sintetiza un ARN largo-tiene más de 15.000 ribonucléotidos-que uniéndose a todo lo largo de ese cromosoma lo heterocromatiniza e inactiva impidiendo que se transcriban sus genes a ARN mensajero primero y posteriormente a proteínas. Era de las primeras veces que se encontraba que un ARN largo no codificador de proteínas pudiese tener una función de regulación de la actividad génica, algo que posteriormente se ha visto que ocurre en diversas situaciones biológicas.
Y asimismo en relación con el cromosoma X activo de las hembras se ha encontrado otro mecanismo genético excepcional. Concretamente lo que sucede en ese cromosoma es que a partir del gen Xist se sintetiza otro ARN diferente al anteriormente mencionado. Pero eso sucede a partir de la hebra opuesta de la doble hélice del gen –y en dirección contraria- de la que se transcribe en el cromosoma inactivo. Este ARN se llama Tsix-Xist leído al revés. Es más largo aún que el Xist, tiene unas 40.000 bases, y con su síntesis en el cromosoma X activo se impide que se sintetice el ARN Xist con función inactivadora 3. Se trata también de uno de los primeros casos en el que se observaba que se transcribieran dos ARN diferentes a partir de un solo gen: uno en una dirección de la doble hélice del gen y otro en dirección contraria, y en el que además uno de los ARN interfiere con el otro pues es el Tsix impide que se sintetice el Xist-sería un anti-Xist.
IMPLICACIONES CLÍNICAS DE LA LIONIZACION
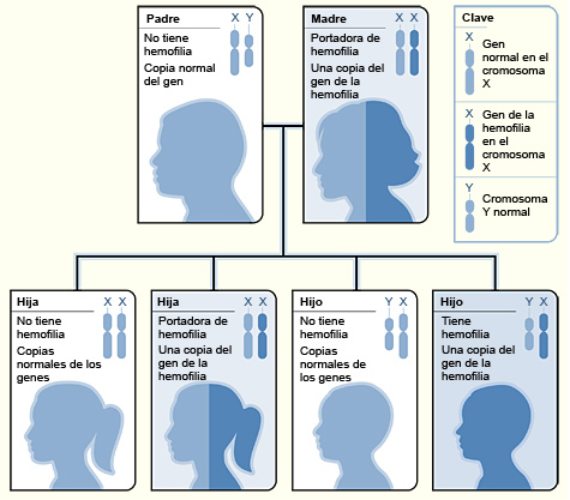
El fenómeno de lionización que experimentan en el desarrollo las mujeres y las hembras de los mamíferos en general puede tener también consecuencias clínicas. Y es que normalmente las mujeres tienen menos probabilidad que los varones de verse afectadas por enfermedades debidas a mutaciones en los genes que van en los cromosomas X. Ello es debido a que las mujeres tienen dos cromosomas X, y si uno lleva un gen mutado lo puede suplir con el normal que va en el otro X, cosa que no sucede en los varones porque sólo tienen un X. Esto es lo que sucede concretamente con enfermedades como la hemofilia que supone la aparición de hemorragias por faltar un factor de coagulación de la sangre. En este caso los varones pueden ser hemofílicos por la mutación en el gen de su único cromosoma X a partir del que se sintetiza tal factor. En cambio, aunque las mujeres pueden ser portadoras de un gen mutado en uno de los X, con el gen normal en el otro X se produce suficiente factor de coagulación para no tener hemorragias, Y ello pese a que sólo se exprese en la mitad de sus células y que sólo se produce el cincuenta por ciento de la cantidad normal del factor. Con ese nivel es suficiente para protegerlas de hemorragias, sobre todo porque el factor de coagulación se libera de las células y circula por el torrente sanguíneo pudiendo actuar en todo el cuerpo.
Pero hay situaciones en las que la presencia en las mujeres de un cromosoma X con un gen funcional frente a otro X con una copia mutada no las protege frente a la enfermedad .Es lo que sucede, por ejemplo, en el síndrome de Rett que se presenta sobre todo en mujeres y que se manifiesta como una grave discapacidad cognitiva-una forma extrema de autismo- que va en aumento a lo largo de su vida 4. Este síndrome es debido a una mutación en un gen presente en el cromosoma X a partir del cual se sintetiza una proteína que uniéndose al ADN en muchos sitios regula la expresión de otros muchos genes, algo que sucede sobre todo en el cerebro. Mientras que las mujeres con mutación en los dos genes o los varones con mutación en su único cromosoma X no serían viables, las mujeres heterocigóticas con un gen normal y otro mutado sí lo son, aunque con el síndrome. En este caso lo que sucede es que sólo la mitad de las células del cerebro de las enfermas expresan el gen normal-las células que han inactivado el X con la mutación-. Pero la otra mitad, al inactivar el X con el gen normal no producen la proteína. Y con la mitad de las células nerviosas produciendo esta proteína no sería suficiente para el funcionamiento normal del cerebro.
PERSPECTIVAS Y CONCLUSIÓN
Como decimos la hipótesis de la lionización ha llegado totalmente vigente hasta nuestros días. Sin embargo, sigue siendo una materia de activa investigación en varios aspectos. En primer lugar, se está investigando mucho sobre el propio mecanismo de la inactivación: sobre todos los factores proteicos que interaccionan con los ARNs que actúan en principio, sobre los efectos de estos factores sobre la estructura del ADN y los genes que se inactivas etc. Y en segundo lugar, se investiga sobre las posibles desviaciones del proceso: los casos en que la inactivación no sucede al azar inactivándose en algunas mujeres preferencialmente bien el cromosoma X de origen materno o el paterno; o sobre la existencia de genes que escapan a la inactivación en el cromosoma X que se heterocromatiniza . Toda esta investigación tiene interés no sólo desde el punto básico sino clínico por cuanto, por ejemplo, estos dos últimos fenómenos pueden estar implicados en determinadas enfermedades y en el cáncer. Asimismo muy recientemente se está investigando hasta qué punto la mayor sensibilidad de los hombres a la infección por el coronavirus SARS-CoV-19 puede estar relacionada con la mayor producción en ellos de la proteína de las membranas celulares, la ECA2- Enzima Convertidora de Angiootensina2, en inglés ACE2, ACE Converting Enzyme 2- que utiliza el virus para entrar en las células 5. El gen que controla esta enzima está situado en los cromosomas X, y si lo que sucede en los varones es que producen mayor cantidad de ECA2 que las mujeres y por ello son más sensibles a la infección, la pregunta es: ¿Cómo se produce esta diferencia cuando la hipótesis de Lyon predice que debe de darse una producción igualada entre los dos sexos? ¿Será debida esta diferencia a la actuación de las hormonas masculinas sobre el gen?
La iniciadora de todo este campo de investigación, Mary F. Lyon, vio aceptada su hipótesis y reconocido su trabajo al formar parte de sociedades científicas tan importantes como la Royal Society, aunque tuvo oposición, o la Academia de Ciencias de EE UU, e incluso vio como se le dio su nombre a un laboratorio en el instituto donde desarrolló su trabajo: el Mary Lyon Centre en Harwell, o la instauración en 2014 de la Mary Lyon Medal de la Sociedad de Genética del Reino Unido. Pero no se le concedió el Premio Nobel que según muchos científicos tenía merecido por su revolucionaria, completa y fructífera hipótesis.
Bibliografía
-
Lyon, MF. 1961.Gene Action in the X-chromosome of the mouse. Nature, 190:372-373.El primero de una serie de trabajos en el que desarrolló su hipótesis.
-
Brown, C.J. et al.1991. A gene from the region of the human X inactive centre is expressed exclusively from the Inactive X chromosome. Nature, 349: 38-44.
-
Lee JT et al.1999. Tsix, a gene antisense to Xist at the X inactivation center. Nat Genet, 21(4):400-4.
-
Bienvenu, T. et al. 2000. MECP2 mutation account for most cases of typical forms of Rett syndrome. Hum. Mol. Genet. 9:1377-1384
-
Sama, I.E et al. 14 Mayo-2020. Circulating plasma concentration of Angiotensin Converting Enzyme 2 in men and women. Eur.Heart Journal. 41(19): 1810-1817.
Manuel Ruiz Rejón
Universidad de Granada, Universidad Autónoma de Madrid y co-autor del libro La Herencia del Mendelismo
Comentarios sobre esta publicación