En la época de nuestros tatarabuelos la esperanza de vida media era de 47 años. No porque la gente muriese a esa edad, sino porque las muertes infantiles estaban a la orden del día. Quien entraba en un quirófano tenía una posibilidad contra tres de sobrevivir. Casi la cuarta parte de los decesos en un país como EEUU se debían a infecciones bacterianas. Una visita al dentista, un dolor de garganta o cualquier pequeña herida podían tener consecuencias fatales, y a menudo una infección solo podía contenerse amputando. Así era el pasado sin antibióticos, hasta que en los años 40 el uso de la penicilina lo cambió todo. Pero por desgracia, solo temporalmente: hoy el gravísimo problema de las llamadas superbacterias resistentes a antibióticos, calificado como una “pandemia ignorada” y como una de las diez mayores amenazas a la salud global, nos sitúa ante la escalofriante perspectiva de devolvernos al mundo de nuestros tatarabuelos, un mundo sin armas contra las infecciones bacterianas.
El descubrimiento de la penicilina por Alexander Fleming en 1928 y su posterior desarrollo por el equipo de Howard Florey y Ernst Boris Chain han sido elogiados como el mayor triunfo en la historia de la medicina. Hoy el abuso del término “hallazgo revolucionario” casi lo ha vaciado de sentido, pero ningún otro lo merece tanto: en la edad dorada de los antibióticos, de los años 50 a los 80, la esperanza de vida aumentó hasta los 78 años, y las enfermedades bacterianas dejaron de ser una preocupación para la población de los países desarrollados. A menudo se cita al entonces cirujano general de EEUU William Stewart cuando en 1967 dijo que era “hora de cerrar el libro sobre las enfermedades infecciosas, de declarar ganada la guerra contra las plagas”. Y aunque al parecer Stewart nunca dijo tal cosa, lo cierto es que la frase refleja una visión muy común en la época.
Tercera causa global de muerte
Pero en el camino de ese futuro soñado se han interpuesto las bacterias multirresistentes. Durante años la resistencia a antibióticos se ha contemplado como “un riesgo abstracto para la salud, una posible causa de enfermedad y muerte en algún momento futuro. Esta forma de pensar hace fácil ignorarlo”, advertía en enero de 2022 un editorial en la revista The Lancet, para añadir que “las nuevas estimaciones exhaustivas muestran que la resistencia a antimicrobianos está matando a un gran número de personas ahora”. El editorial venía motivado por la publicación de los resultados del estudio más completo hasta hoy, el GRAM (Global Research on Antimicrobial Resistance), liderado por la Universidad de Oxford y el Institute for Health Metrics and Evaluation (IHME) de la Universidad de Washington en Seattle.
Los resultados del GRAM, referidos a 2019, revelan que ese año la resistencia a antimicrobianos estuvo asociada a 4,95 millones de muertes en el mundo, 1,27 millones de ellas causadas directamente por las bacterias resistentes. El GRAM reúne datos de 204 países y territorios sobre 23 tipos de bacterias y 88 resistencias específicas. La bacteria causante de más muertes fue un microbio intestinal común, Escherichia coli, mientras que la resistencia específica más letal fue la de Staphylococcus aureus al antibiótico meticilina. Los datos sitúan la resistencia a antimicrobianos como la tercera causa global de fallecimientos si se cuentan todas las muertes asociadas, o la duodécima, casi a la par con la suma de sida y malaria, si se consideran las causadas directamente.
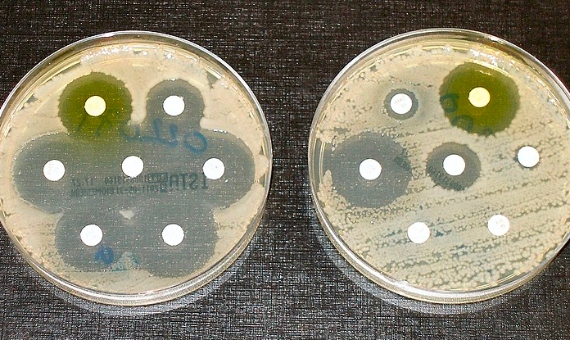
Por el momento el GRAM solo ha publicado los datos relativos a 2019, pero según adelanta a OpenMind el codirector del estudio Mohsen Naghavi, del IHME, actualmente trabajan en el análisis de la tendencia a lo largo del tiempo. Sin embargo, otros estudios han mostrado que el problema de la resistencia se está agravando. En 2019 un informe de Naciones Unidas, la Organización Mundial de la Salud y otras instituciones estimaba que, al ritmo actual, en 2050 las muertes por esta causa podrían ascender hasta 10 millones al año.
Todo lo cual resulta aún más alarmante cuando no se trata ni mucho menos de un problema nuevo ni imprevisto, sino tan viejo que ya en 1945, con ocasión de recibir el Nobel, el propio Fleming advirtió de que un uso excesivo de los antibióticos podía favorecer la proliferación de microbios resistentes. Y, en realidad, el problema de las resistencias es tan antiguo como la vida; conviene aclarar que los antibióticos no necesariamente son la causa de las resistencias, sino que estas surgen en la naturaleza por mutaciones genéticas azarosas.
La resistencia bacteriana, un juego de números
Una buena muestra de ello es el trabajo de Ivan Erill en la Universidad de Maryland en el Condado de Baltimore y sus colaboradores en la Universitat Autònoma de Barcelona. En 2019 descubrieron que la resistencia a las sulfamidas, antibacterianos utilizados antes de los antibióticos, surgió en la naturaleza hace 500 millones de años. A diferencia de los antibióticos, producidos por hongos o derivados de ellos, las sulfamidas son sintéticas; fueron inventadas por el ser humano. Y pese a ello, versiones mutantes de la enzima atacada por estos fármacos son casi tan viejas como las propias bacterias. “La resistencia precede a la existencia de los propios antimicrobianos”, resume Erill a OpenMind. Según explica este bioinformático, “es un juego de números”: con una población bacteriana estimada de cinco millones de billones de billones, dice, la diversidad genética es tan inmensa que “es casi seguro que en algún lugar hay una bacteria resistente a cualquier fármaco que puedas imaginar”.
Sin embargo, una vez surgidas estas resistencias, que según Erill para todo nuevo antibiótico aparecerán “en años, si no meses”, el uso de los antibióticos sí provoca un mayor crecimiento de las cepas resistentes frente a las sensibles, así como el intercambio entre las bacterias de genes portadores de esta resistencia, en una especie de evolución bajo demanda ante la presión de los fármacos. “Con la presión selectiva, lleva poco tiempo la acumulación de suficientes mutaciones para una total resistencia”, dice Erill.
Por todo ello, los expertos demandan más inversión, esfuerzo y colaboración internacional pública y privada para establecer mecanismos globales de lucha contra la resistencia a antibióticos, aprendiendo de la eficaz y rápida respuesta del mundo contra la COVID-19. Los autores del GRAM apuntan cinco grandes líneas en las que debe actuarse: prevención y control de las infecciones, vacunación, moderar el uso de antibióticos —incluyendo la ganadería—, eliminar su uso cuando no son necesarios —como en las infecciones virales— y desarrollar nuevos antibióticos.
En cuanto a las dos primeras líneas, que buscan prevenir las infecciones en primer lugar, para los autores del GRAM son sin duda las más esenciales. “Es de sentido común que la más importante prevención de las muertes por infección es la vacunación y mejorar los factores de riesgo relacionados con la higiene”, subraya Naghavi. La mitigación de estos riesgos incluye también el saneamiento de aguas y la infraestructura de gestión de residuos allí donde son deficientes. En cuanto a las vacunas, actualmente solo existen contra una de las seis bacterias más peligrosas, el neumococo Streptococcus pneumoniae.+
Restringir el uso de antibióticos y el riesgo de las medidas anti-COVID
Respecto al uso de los antibióticos, generalmente en los países desarrollados existe más control y concienciación que en otras áreas del mundo en desarrollo, donde a menudo se venden sin prescripción ni regulación y se consumen en mayores cantidades. Los expertos advierten especialmente del riesgo de los fármacos caducados y de los tratamientos incompletos; en estas situaciones, un nivel del principio activo por debajo del óptimo es especialmente propenso a favorecer el crecimiento de las cepas menos sensibles.
Pero una asignatura pendiente es la ganadería. El 66% de los antibióticos se usan en animales de granja. Estos fármacos pasan a la cadena alimentaria y se vierten al medio, contaminando las aguas, a lo que se unen los vertidos de las plantas de producción. En 2017 Michael Gillings, de la Universidad Macquarie en Australia, y sus colegas de la Academia China de Ciencias revelaron que los estuarios de los ríos de China contienen hasta 100 millones de genes de resistencia a antibióticos por gramo de lodo. Según Gillings, esto equivale a un millón de genes de resistencia en la cabeza de una cerilla. “Todos los entornos ambientales investigados tienen genes de resistencia”, resume a OpenMind. No todos los presentes en el medio ambiente son resultado de la polución, aclara, pero muchos de los naturales se transfieren a las bacterias patógenas, y pueden incluso diseminarse a través del aire. Por lo tanto, a la polución de los antibióticos se une la de los propios genes de resistencia en el entorno.

La pandemia de COVID-19 ha contribuido también a agravar el problema. “La mayoría de los pacientes de coronavirus también han recibido antibióticos para el tratamiento de infecciones bacterianas secundarias”, señala a OpenMind la microbióloga de la Universidad de Westminster Manal Mohammed. “Este aumento masivo de los antibióticos sin duda contribuirá al crecimiento de las bacterias resistentes”. Pero además la COVID-19 ha potenciado otro factor de riesgo, el abuso de desinfectantes como los geles de manos y los productos antibacterianos. Investigaciones anteriores a la pandemia ya habían revelado la aparición de cepas bacterianas resistentes, o mejor dicho tolerantes, a muchos de los compuestos de estos productos, incluyendo el propio alcohol.
Un estudio de 2016 encontró una resistencia del 48% en E.coli y del 64% en Pseudomonas aeruginosa a 25 marcas diferentes de geles de manos. Aún no se conoce con detalle cómo las bacterias se hacen fuertes frente a estos compuestos; se ha señalado que dichas sustancias estimulan los sistemas de bombeo en las membranas celulares bacterianas que los expulsan al exterior —como la bomba de un barco expulsa el agua—, o que inducen daños en el ADN que pueden dar lugar a mutaciones de resistencia. También se ha sugerido que ciertos desinfectantes estimulan el intercambio de ADN entre bacterias, lo que puede extender los genes de resistencia. Sea cual sea el mecanismo, los expertos están alertando de que el abuso actual de desinfectantes no hará sino empeorar el problema.
Antibióticos y vacunas de nueva generación
El desarrollo de nuevos antibióticos es un punto especialmente crítico. Desde que el último de los tipos de estos fármacos surgiera en los años 80, se ha abierto lo que se conoce como un vacío de descubrimiento, décadas sin ninguno nuevo. La rápida expansión de las resistencias “crea un problema de incentivo para la industria farmacéutica”, comenta Erill. Es decir, las compañías no ven rentabilidad en la inversión en nuevos antibióticos. “Para mí, el problema es que todavía piensan en esto en términos de un modelo de negocio obsoleto”: quieren aplicarlos a mansalva y venderlos “por toneladas, no por microgramos”, dice. Incluso en estos casos, añade, los genéricos anularán el beneficio. Para Erill, las posibles soluciones pasan por la investigación pública o la regulación del mercado, no solo restringiendo el uso, sino también fijando precios que aseguren la rentabilidad.
Mientras, la ciencia explora vías alternativas. “Las vacunas son una posible respuesta, pero requieren dinero gubernamental para investigar”, apunta Gillings. Otra posibilidad es el uso de virus matabacterias, llamados bacteriófagos o fagos. Esta línea surgió a comienzos del siglo XX, pero quedó casi abandonada con el descubrimiento de los antibióticos. El interés se ha reavivado en tiempos recientes y hoy centra los estudios de numerosos grupos, incluyendo el de Manal Mohammed. Un inconveniente es que las bacterias también se vuelven resistentes a los fagos, pero la combinación de distintas armas puede ser clave: cuando cierta bacteria se vuelve resistente a un fago lo hace desprendiéndose de la cubierta que el virus aprovecha para atacarla, pero la desaparición de esta envoltura vuelve a la bacteria vulnerable frente a un antibiótico al que antes era resistente.

En definitiva, los grandes problemas piden grandes soluciones. En un artículo en The Conversation, el profesor emérito de la Universidad de Manchester Mukesh Kapila, experto en salud global, urgía a afrontar la crisis de la resistencia a antimicrobianos con “una organización dedicada con la legitimidad universal de unas Naciones Unidas, el peso político de un G20, el bolsillo de un fondo global, la capacidad intelectual de una agencia espacial, el entusiasmo activista de una ONG, el poder de romper moldes de un movimiento social y el empuje de una colaboración pública-privada”.
Comentarios sobre esta publicación