Si los cubitos de hielo se hundieran en lugar de flotar, no nos causaría un gran trastorno; solo habría que remover la bebida de vez en cuando para que la parte superior se enfriara. Salvo por el hecho de que no habría bebida que remover ni nadie para hacerlo, porque no existiría la vida en la Tierra. O, al menos, los humanos no estaríamos aquí.
La flotación del hielo es una de las rarezas del agua, una sustancia tan familiar que nos parece corriente, pero que no tiene nada de ordinario. Tan diferentes son sus propiedades de lo que cabría esperar de su composición química, que comprender cómo su estructura microscópica causa un comportamiento tan singular es algo que “se ha discutido intensamente durante más de 100 años y todavía no se ha resuelto”, como escribían en una reciente revisión los físicos Lars Pettersson y Anders Nilsson, de la Universidad de Estocolmo (Suecia), y Richard Henchman, de la Universidad de Manchester (Reino Unido).
Su crucial papel bioquímico
Todo estudiante sabe que las sustancias se contraen al enfriarse y se dilatan al calentarse, lo que permitió la invención del termómetro. También el agua caliente reduce su volumen al enfriarse. Pero por debajo de los 4 °C, ocurre algo extraordinario: comienza de nuevo a dilatarse, como sabe todo el que ha congelado una botella demasiado llena. El resultado es que el hielo es menos denso que el agua líquida y por ello flota, un fenómeno que ya interesó a Galileo Galilei, cuando en 1612 razonaba que “el hielo debería ser más bien agua rarificada que condensada”.
Pero ¿qué ocurriría de no ser así? En los océanos, lagos y ríos, la capa flotante de hielo que se forma en invierno impide que escape el calor, manteniendo en estado líquido el agua que yace debajo. Si el hielo cayera al fondo, continuaría formándose más cantidad hasta que todo se convirtiera en una gran masa sólida; el calor de la superficie solo lograría fundir una delgada capa superior, lo que habría imposibilitado la evolución de la vida compleja como hoy la conocemos. Además del papel bioquímico crucial del agua, la biología, la geología y la dinámica de los océanos fueron fundamentales para hacer de la Tierra un planeta habitable.

No es ni mucho menos la única propiedad inusual del agua. Por su fórmula química, como óxido de hidrógeno (H2O), debería seguir la pauta que marcan el sulfuro de hidrógeno (H2S), seleniuro de hidrógeno (H2Se) o telururo de hidrógeno (H2Te), compuestos similares con los elementos que siguen al oxígeno en su grupo de la tabla periódica. Si así fuera, el agua debería hervir por debajo de -80 °C y congelarse hacia -100 °C. Por suerte para la vida terrestre, sabemos que no es así; de hecho, su congelación a 0 °C y su ebullición a 100 °C —a nuestra presión atmosférica normal— no solo le confieren una amplia franja de temperaturas en estado líquido, sino que la convierten en la única sustancia que en las condiciones habitables de la Tierra puede encontrarse en forma sólida, líquida y gaseosa.
Un raro fenómeno físico-químico
De lo anterior puede intuirse que las propiedades aberrantes del agua son, como confirma a OpenMind el químico Martin Chaplin, profesor emérito de la London South Bank University, “totalmente responsables” de la existencia de la vida en la Tierra. De hecho, añade Nilsson, curiosamente “parece que el agua se vuelve anómala a las temperaturas a las que normalmente existe la vida”. Pero ¿a qué clase de raro fenómeno físico-químico debemos agradecer nuestra existencia? Según Chaplin, “hay varias explicaciones, pero ninguna de ellas ha demostrado ser concluyente o plenamente inclusiva”. En su origen están las peculiares características del oxígeno, uno de los elementos más electronegativos de la tabla periódica. Al combinarse con el hidrógeno atrae los electrones hacia sí con tal fuerza que la molécula de agua, aunque eléctricamente neutra en su conjunto, forma dos polos, negativo y positivo.

Este carácter dipolar del agua es clave, ya que le permite formar enlaces llamados de puente de hidrógeno. En comparación con otros compuestos en apariencia similares, “la formación de puentes de hidrógeno en el agua es mucho más fuerte y más extensiva”, dice Chaplin. Estos enlaces confieren al agua un comportamiento pegajoso que es responsable de su enorme tensión superficial —la mayor en un líquido exceptuando el mercurio— y de que pueda actuar al mismo tiempo como lubricante y adhesivo entre superficies.
Intensos debates científicos
Son las estructuras microscópicas derivadas de estos enlaces, las cuales a su vez determinan las propiedades anómalas, las que aún mantienen a los científicos inmersos en intensos debates. El hielo tiene una estructura estable tetraédrica, con una molécula de agua en el centro unida por puentes de hidrógeno a otras cuatro en los vértices. Este ordenamiento regular espacioso es el causante de la baja densidad del agua congelada. Solía pensarse que al pasar al estado líquido, esta estructura simplemente se volvía más dinámica, rompiéndose y formándose puentes de hidrógeno a razón de un billón de veces por segundo, dando como resultado una masa más compacta.
Pero en 2004 Nilsson, Pettersson y sus colaboradores descubrieron que en el agua líquida las moléculas tienden a abandonar la estructura tetraédrica y a formar solo dos puentes de hidrógeno. “Propusimos que la estructura dominante está muy distorsionada”, dice Nilsson. “Desde entonces también hemos postulado que existen dos dominios estructurales fluctuantes, líquido de alta y de baja densidad”. El modelo plantea que el agua líquida no forma una estructura homogénea, sino que es una mezcla de dos diferentes, una tetraédrica ligera y otra densa y desordenada que predomina a temperatura ambiente. Esta surge cuando el hielo se descongela, aumentando su densidad, pero por encima de 4 °C el aumento de la forma densa induce una repulsión entre las moléculas que resulta en la dilatación térmica.
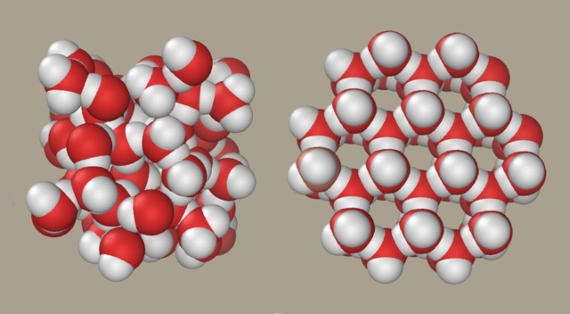
Así, según el modelo de Nilsson y Pettersson, estas dos estructuras diferentes y rápidamente cambiantes conviven en el mismo líquido en las condiciones ambientales terrestres. A temperaturas o presiones extremas, el agua adopta solo una de las dos configuraciones y se comporta como un líquido cualquiera, sin esas rarezas que hacen de ella el líquido más extraño del universo y a las cuales debemos nuestra existencia.
Comentarios sobre esta publicación