La inteligencia artificial (IA) se ha convertido en una herramienta prometedora en el descubrimiento de fármacos ya que puede mejorar las probabilidades de éxito y aportar mayor precisión, rapidez y rentabilidad a un proceso con altos índices de fracaso, tiempos de desarrollo muy largos y costes elevados.
En esta ocasión hablaremos de un proceso conocido como cribado virtual. Se trata de soluciones digitales desarrolladas para identificar nuevas moléculas contra blancos celulares específicos y, de esta forma, acelerar el descubrimiento de nuevos fármacos. Hasta la fecha, la falta de estructuras proteicas disponibles y la escasa diversidad de las colecciones de compuestos impedían una aplicación generalizada de este enfoque. Hoy en día, la disponibilidad de amplias y diversas bibliotecas químicas virtuales y el acceso a las estructuras de casi todas las proteínas, representan dos avances fundamentales que permiten adoptar con éxito el cribado virtual. Además, la sustitución de las herramientas de acoplamiento clásicas por procedimientos de acoplamiento basados en aprendizaje automático, liberarán todo el potencial del cribado virtual, haciendo que el descubrimiento de fármacos sea más eficiente, rentable y asequible para muchas empresas con presupuestos modestos en el sector de la biotecnología.
El proceso para descubrir un nuevo tratamiento farmacológico
La búsqueda de un nuevo tratamiento farmacológico comienza con la identificación de compuestos químicos o moléculas que puedan servir como prototipos de medicamentos (“fármacos candidatos”) dirigidos contra una diana terapéutica conocida y relevante en una patología determinada. El primer paso es el cribado de alto rendimiento (“HTS”), un proceso de pruebas automatizadas en donde se ensayan compuestos químicos para discernir su actividad biológica y, por tanto, un potencial terapéutico basado en el efecto que muestran en dicha prueba. Cuanto más amplia y diversa sea la colección de compuestos analizados, mayores serán las posibilidades de encontrar una molécula valiosa que pueda convertirse en un fármaco. Y aunque el HTS es una técnica avanzada que ahorra costes y ha mejorado drásticamente la eficiencia en la búsqueda de fármacos candidatos, el acceso a colecciones de compuestos químicos grandes y diversas puede ser costoso, y el cribado de millones de moléculas puede llevar meses.
Genetic Fingerprint by Topazium
El cribado virtual o in silico
El cribado virtual es el análisis mediante simulación o modelización realizado de manera virtual (“in silico”) sobre una diana terapéutica en particular con unos pocos miles a millones de compuestos químicos virtuales.
Esta tecnología permite identificar pequeñas moléculas (ligandos) que pueden unirse a una diana terapéutica y modular su función, corrigiendo así el papel perjudicial que desempeña en el desarrollo de una enfermedad particular. La demostración in silico de la interacción de una molécula con una diana biológica no supone la confirmación de su actividad biológica beneficiosa ya que los compuestos identificados mediante cribado virtual deben someterse a pruebas biológicas de laboratorio que verifiquen y cuantifiquen su interacción con las dianas terapéuticas ensayadas. Pero el cribado virtual ofrece una forma rápida y eficaz de preseleccionar un subconjunto de moléculas para pruebas posteriores, evitando la necesidad de analizar colecciones enteras de compuestos.
¿Cómo funciona?
La diana terapéutica es una molécula biológica que desempeña un papel fundamental en el proceso de desarrollo de la enfermedad a nivel celular. Una vez identificada la diana relevante, se buscarán compuestos químicos que se unan a ella y modulen su actividad, corrigiendo de esta manera el problema. Es de destacar que la mayoría de las dianas terapéuticas utilizadas en la actualidad son proteínas. Para que el cribado virtual tenga éxito, debemos conocer la estructura tridimensional (3D) de la diana terapéutica lo más detallada posible. Tradicionalmente, la determinación precisa de la estructura 3D requería sofisticadas tecnologías ópticas como la difracción de rayos X o la criomicroscopía electrónica. Sin embargo, los recientes avances en diversas herramientas de IA como Helixfold o Alphafold, han permitido predecir la estructura 3D de casi todas las proteínas que se encuentran en los organismos vivos con un alto nivel de precisión convirtiendo al cribado virtual en una opción viable para buscar compuestos químicos que puedan unirse a prácticamente todas las dianas terapéuticas posibles. Mientras que el HTS requeriría el acceso a compuestos químicos reales, adecuadamente almacenados en viales en colecciones específicas, y la capacidad de sintetizarlos en las cantidades necesarias para las pruebas, el cribado virtual aprovecha las colecciones virtuales. Por lo tanto, el cribado virtual no sólo puede aportar al descubrimiento de fármacos la eficacia y el ahorro que tanto necesitan las empresas farmacéuticas, sino que también puede mejorar enormemente las posibilidades de éxito al aumentar significativamente la diversidad del espacio químico susceptible de búsqueda.
Los retos y los avances en el cribado virtual
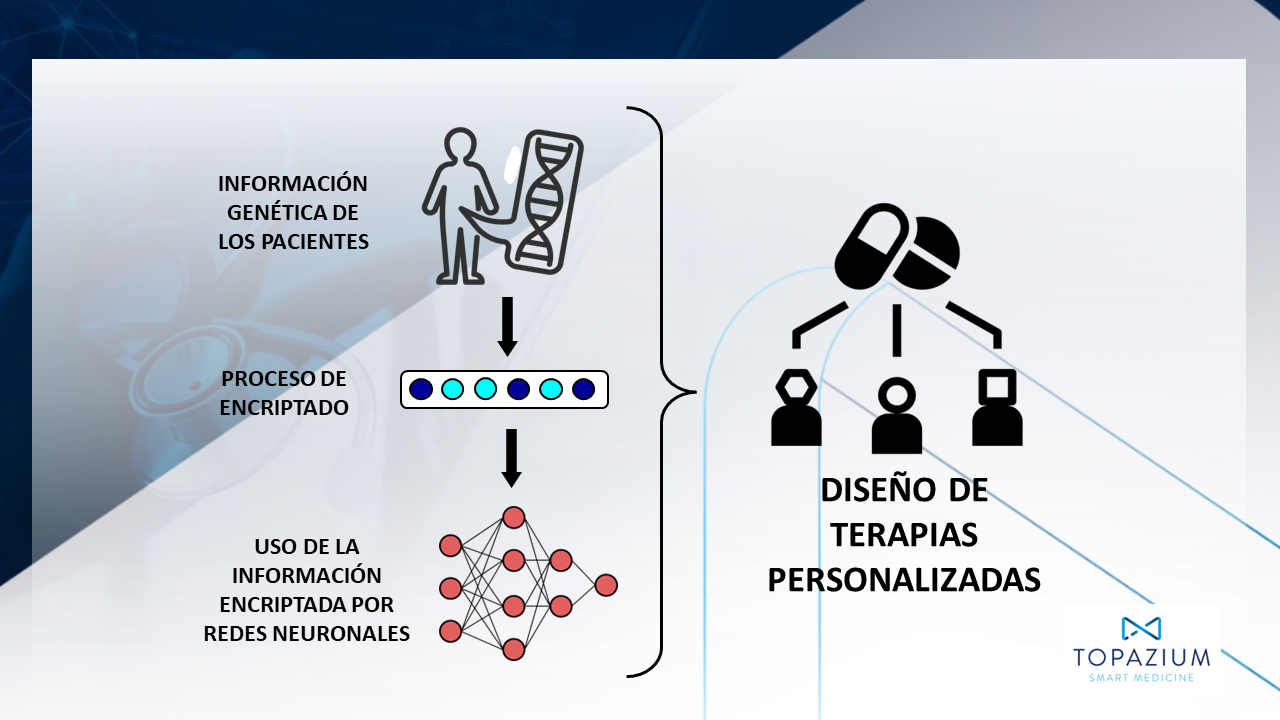
El primer gran desafío en la estrategia de descubrimiento de nuevos fármacos es la identificación de una diana fisiológicamente relevante. En la actualidad las dianas se identifican principalmente a través de estudios de secuenciación de genoma o de expresión génica. Sin embargo, el análisis de este tipo de información es muy costoso y requiere mucho tiempo. La IA surge como una respuesta tecnológica muy eficaz para hacer frente a este reto. Por ejemplo, en Topazium, desarrollan una herramienta llamada Genetic Fingerprint que aprovecha la información genética de tumores de pacientes con cáncer para identificar posibles dianas terapéuticas únicas. La herramienta codifica esta información utilizando tecnología similar a la empleada en la creación de criptomonedas o en los sistemas de información cifrada para generar un “genoma tumoral virtual” de cada paciente del que puede estudiarse su evolución clínica. De este modo, la herramienta permite seleccionar aquellos genomas relacionados con peor pronóstico para identificar las mutaciones génicas más representativas responsables de la evolución clínica desfavorable. Estas mutaciones nocivas revelan los puntos de intervención sobre los que puede actuar un fármaco para atacar las células tumorales, favoreciendo el desarrollo de terapias personalizadas.
Genetic Fingerprint by Topazium
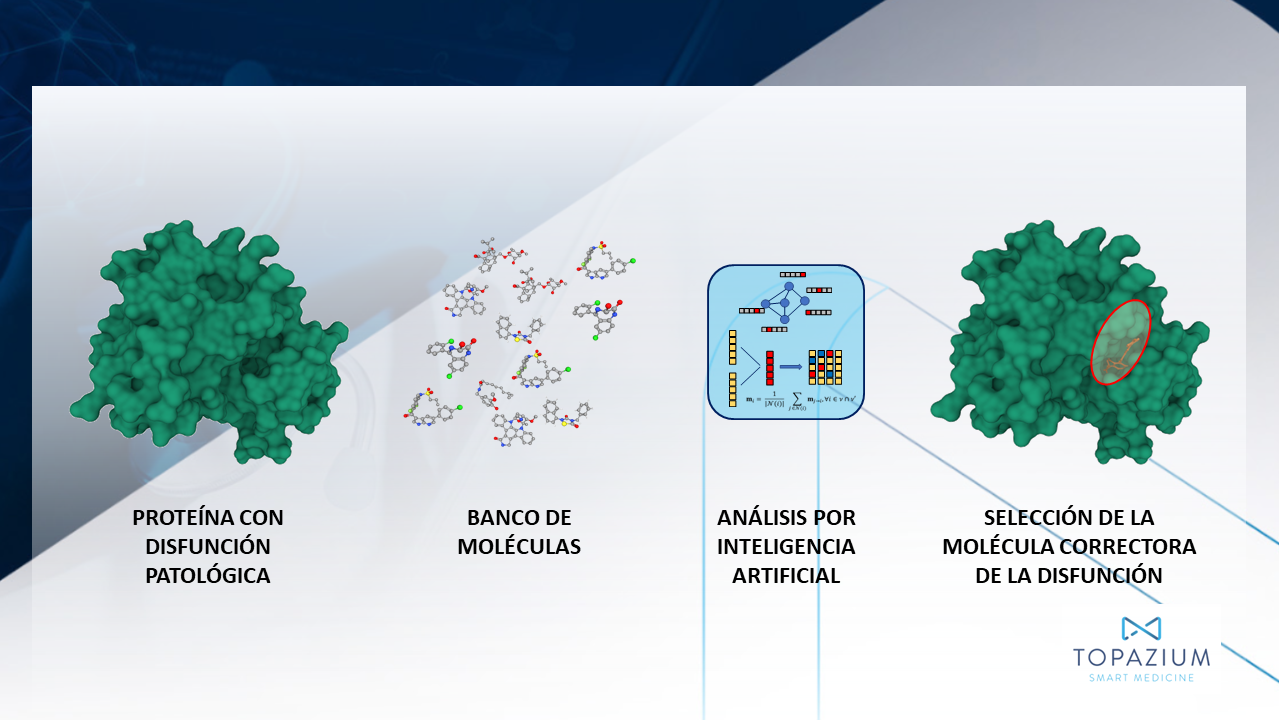
Por otra parte, gracias al conocimiento de la estructura tridimensional de las proteínas diana y al acceso a colecciones virtuales de moléculas, los investigadores pueden realizar un cribado virtual para analizar la afinidad con la que se prevé que las moléculas se unan a su diana. Una simulación informática conocida como acoplamiento molecular permite explorar las distintas conformaciones y orientaciones (denominadas colectivamente “pose”) que puede adoptar una molécula pequeña dentro de las hendiduras naturales (sitios de unión) de la estructura proteica. Mediante este análisis, los investigadores buscan posturas especialmente favorables determinadas por el estado termodinámico de la molécula; en particular, el nivel de energía libre asociado a la postura. Las moléculas que presentan las posturas más favorables se consideran “hits” y pasan a las siguientes fases del descubrimiento de fármacos.
Los avances en aprendizaje automático (ML) realizados en los dos últimos años han mejorado drásticamente los procedimientos de acoplamiento, principalmente al considerar las estructuras dinámicas tanto de las proteínas como de los ligandos en solución. Las nuevas herramientas de ML introducen mejoras significativas en el rendimiento y la precisión de los procedimientos de acoplamiento. Se espera que su uso en paralelo con ordenadores de alto rendimiento suponga un salto adelante en la eficiencia y fiabilidad del cribado virtual, aprovechando al máximo la rica información estructural proporcionada por sistemas predictores de la estructura 3D de proteínas y la riqueza de la diversidad química ofrecida por las grandes colecciones virtuales.
En resumen, hoy en día, la IA ya puede ayudarnos a descubrir nuevas indicaciones para medicamentos existentes (reposicionamiento), identificar nuevos candidatos a fármacos y diseñar nuevos compuestos químicos que podrían permitir tratamientos novedosos contra enfermedades raras o letales.
Carlos Galmarini
CEO Topazium
Comentarios sobre esta publicación