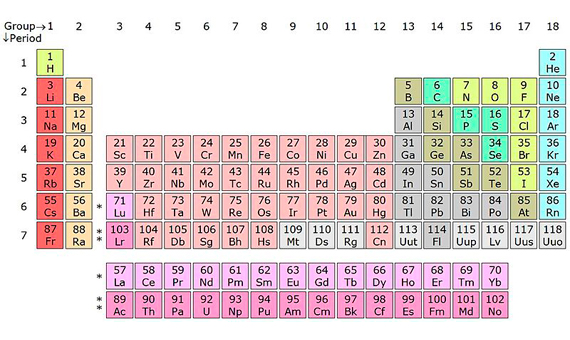
Ununtrio, unumpentio, ununseptio y ununoctio. Son términos enrevesados, pero son solo nombres sistemáticos provisionales; en poco tiempo serán reemplazados por los definitivos, después de que el 30 de diciembre de 2015 la ciencia diera la bienvenida oficial a estos cuatro nuevos elementos químicos. Sus nombres temporales se refieren a sus números atómicos (Z), o número de protones: 113, 115, 117 y 118, respectivamente. Con estas cuatro nuevas incorporaciones se da carpetazo a la séptima fila de la tabla periódica de los elementos.
Los estudiantes de química tienen hoy mucho más material para memorizar que en tiempos de Dimitri Mendeleyev (8 de febrero de 1834 – 2 de febrero de 1907), el científico ruso que en 1869 jugó a las cartas con los 63 elementos conocidos hasta la fecha para definir la primera versión de la tabla periódica, que desde entonces ha seguido ampliándose con un constante goteo de nuevos miembros. Hasta llegar al flerovio (114) y el livermorio (116), los dos últimos nombrados en mayo de 2012, el trabajo de los químicos ha ido volviéndose cada vez más arduo: el francio (87), descubierto en enero de 1939 por Marguerite Perey, cerró la época del hallazgo de nuevos elementos en la naturaleza. Dos años antes se había inaugurado la era de la síntesis con el tecnecio (43), confirmado por científicos de la Universidad de Palermo en diciembre de 1936.
El tecnecio, llamado así precisamente por su origen artificial, es uno de varios elementos que fueron creados mediante síntesis antes de descubrirse también en la naturaleza. Pero a medida que los átomos se hacen más pesados, se obtienen elementos radiactivos más inestables, que solo pueden fabricarse en el laboratorio y que se descomponen rápidamente, a veces en fracciones infinitesimales de segundo.
La frontera estricta entre el mundo natural y el laboratorio la marca el plutonio (94), el elemento más pesado con isótopos lo suficientemente estables como para encontrarse en la corteza terrestre. Por encima de él, el americio (95) y el curio (96), ambos creados en 1944, abren la región de la tabla que pertenece exclusivamente a los dominios del laboratorio; o como mucho, a los experimentos o accidentes nucleares propiciados por el ser humano.
Proyectiles más pesados
Los científicos logran sintetizar estos elementos superpesados disparando unos átomos contra otros con la esperanza de que se fusionen, algo que ocurre solo en una de cada miles de millones de colisiones. Así se ha logrado llegar hasta la frontera del elemento 118, el más pesado de los recién llegados. Por ejemplo, el 117 fue obtenido por científicos de Estados Unidos y Rusia bombardeando una muestra de 22 miligramos de berkelio (el elemento 97) con iones del isótopo 48 del calcio durante 150 días en el acelerador de iones pesados del Instituto Central de Investigaciones Nucleares en la ciudad rusa de Dubná. A su vez, el berkelio tardó 250 días en obtenerse en el Laboratorio Nacional de Oak Ridge, en EEUU. Y todo ello para llegar a producir solo seis átomos del 117, que se descomponen en unos milisegundos.
Cómo descubrir un nuevo elemento. Crédito: LLNL
Siendo así, sería de esperar que rebasar la nueva frontera de la tabla periódica hacia la octava fila fuera poco menos que impensable. El bombardeo con calcio ha permitido descubrir seis nuevos elementos, pero según señala a OpenMind el físico David Hinde, director del acelerador de iones pesados de la Universidad Nacional de Australia, “las dificultades de ir más allá del elemento 118 consisten en que emplear proyectiles de calcio-48, que tienen muchas propiedades favorables, ya no es posible; se necesitan proyectiles más pesados”.
Sin embargo, Hinde es uno de los hombres que pueden tener la clave para avanzar a la casilla siguiente. Recientemente ha estudiado el uso de otros proyectiles en colaboración con el Grupo de Elementos Superpesados de la Universidad de Mainz y el Centro GSI, en Alemania. El problema de emplear proyectiles de mayor calibre, expone, es que “reducen la producción de elementos superpesados en un factor de 10 o más”. Entre las posibilidades que cita Hinde se encuentran el titanio-50, el cromo-54, el hierro-58 y el níquel-64.
Por su parte, el físico Jadambaa Khuyagbaatar, perteneciente al grupo alemán que colabora con Hinde y que ha dirigido los experimentos de confirmación del elemento 117, se muestra optimista: “Los resultados nos dan buenas esperanzas de sintetizar al menos los dos elementos siguientes, 119 y 120”, aunque “los experimentos pueden llevar más tiempo que para la síntesis del 114 al 118”, advierte a OpenMind. Y según Hinde, tal vez no baste con cambiar de balas, sino que tal vez también se requieran cañones más potentes: “Se podría superar esta desventaja con nuevos aceleradores con un mayor flujo de partículas”.
Islas de estabilidad
Otro inconveniente es la creciente inestabilidad de los elementos más pesados, que apenas deja a los investigadores un mínimo margen de tiempo para estudiar sus propiedades. Pero por fortuna, parece que no siempre es así. En la década de 1960, el químico y premio Nobel Glenn T. Seaborg propuso que hacia números atómicos mayores podrían aparecer “islas de estabilidad”. La hipótesis se basa en la idea de que los protones y neutrones del núcleo están organizados en capas de energía con una capacidad concreta; la ocupación máxima de estas capas ofrece “números mágicos” que resultan en átomos más estables que sus vecinos más ligeros. La predicción se cumple para el isótopo 208 del plomo, con doble número mágico para protones (82) y neutrones (126), y que es de hecho el núcleo estable más pesado. Las predicciones varían para el siguiente posible número mágico de protones, pero algunos científicos lo sitúan en el elemento 120, o unbinilio.
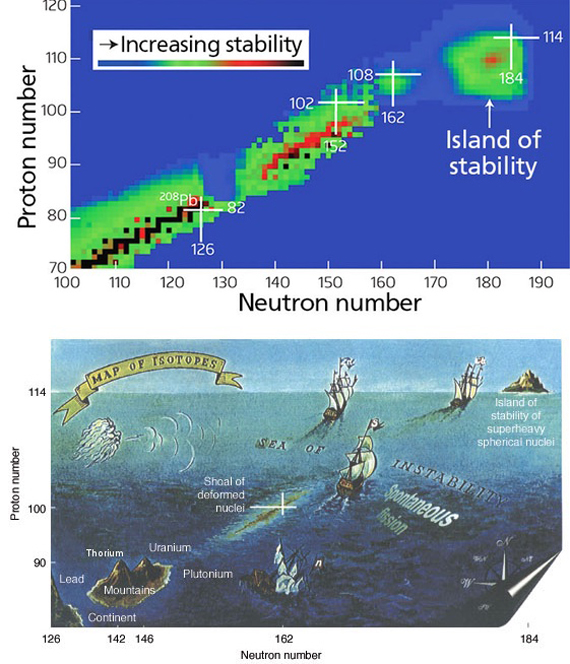
Para Hinde, conquistar esta isla puede ser una empresa complicada; “o imposible, dependiendo de dónde esté el centro”. Sin embargo, el tesoro oculto en ese paraje podría compensar el esfuerzo: “Es improbable que estos núcleos del centro de la isla sean realmente estables, pero deberían tener semividas medidas en muchos años, y no en segundos o menos, como los superpesados actuales”. Y según Khuyagbaatar, al menos estamos ya tocando tierra: “todavía estamos lejos del centro de la isla, pero ya hemos llegado a la costa”.
Comentarios sobre esta publicación