Antecedentes. ¿Por qué sigue resistiéndose el envejecimiento a la intervención médica?
El control médico del envejecimiento es probablemente el sueño más antiguo de la humanidad…, y desde luego su principal problema ahora mismo. Sin embargo, lamentablemente, los progresos obtenidos son pobres. La historia de nuestros intentos por controlar el envejecimiento se resume en una sucesión de pasos equivocados, de enfoques mal orientados y (en retrospectiva) erróneos que nunca tuvieron posibilidades de éxito y que pueden resumirse con tres palabras: enfermedad, designio y privación. Y lo peor es que ni siquiera han sido secuenciales; los primeros han sobrevivido a la llegada de los siguientes.

El falso amanecer del «envejecimiento como enfermedad», también conocido como medicina geriátrica, descansa en la suposición de que las enfermedades de la vejez son inherentemente susceptibles de ser curadas con el mismo tipo de enfoque médico que las enfermedades prevalentes de la juventud, es decir, las infecciones. Surge de la observación de que personas diferentes contraen enfermedades distintas durante la vejez, lo mismo que personas diferentes contraen infecciones distintas, y de ahí se infiere que la misma clase de estrategia empleada con las segundas funcionará con las primeras, lo que se traduce en atacar los síntomas de la enfermedad. Esto resulta descabellado si tenemos en cuenta que las dolencias de la vejez son consecuencia de la acumulación de daños autoinfligidos al cuerpo, mientras que las infecciones proceden de fuera, ¡y por lo tanto pueden ser expulsadas por completo! Pero no ha impedido —y sigue sin impedir— a la humanidad gastar miles de millones de dólares en investigaciones dirigidas a lograr este objetivo tan manifiestamente quijotesco. El hombre prefiere, y con razón, creer que es posible. Al parecer también prefiere creer que estas enfermedades son «curables» y por mucha lógica que se le presente en contra no cambia de opinión.
El falso amanecer de «envejecer como designio» se produjo hace alrededor de un siglo, quizá en parte como resultado de la admisión por parte de algunas personas del argumento anteriormente expuesto. Empezó con la propuesta de August Weismann de que el envejecimiento obedece a un propósito evolutivo, una idea seductora que sobrevivió en su formulación inicial durante varias décadas a pesar de ser inherentemente circular (en esencia, Weissmann decía que envejecer es algo seleccionado porque existe, y viceversa) y que perdura para un pequeño sector de la comunidad científica en una formulación más sofisticada (por lo común expresada en términos de inteligencia evolutiva o «evolubilidad»). Pero ese no ha sido su legado principal. A principios del siglo xx dio lugar a un enfoque que no se apoya en la idea de que existen genes cuya función seleccionada es acelerar el declive funcional del organismo, sino en la de que los genes que determinan la variación entre especies (y la variación menor, pero no por ello insignificante, entre individuos de la misma especie) son más bien pocos en número, y por tanto es realista intentar perfeccionar los miembros de una especie determinada, como el Homo sapiens, para extender su esperanza de vida saludable. Es fácil ver cómo la segunda idea está inspirada en la primera, pero por desgracia no depende de ella (porque se sostiene igualmente si los genes en cuestión son genes antienvejecimiento en lugar de proenvejecimiento), y por tanto su rechazo por parte de la mayoría de los gerontólogos no se produjo como consecuencia lógica del «envejecimiento programado».
De nuevo, sin embargo, debemos hacer la pregunta clave: ¿tiene sentido en realidad la idea de «envejecimiento por designio» como base para los esfuerzos médicos por retrasar el envejecimiento asociado a la mala salud? ¿Es siquiera remotamente compatible con lo que sabemos sobre envejecimiento? De nuevo, la dolorosa respuesta es no. Precisamente por las mismas razones por las que sabemos que el envejecimiento no es programado, también sabemos que es inherentemente caótico y multifactorial. Mecanismos distintos causan daños distintos y caminos genéticos distintos se dedican a ralentizar esos mecanismos y, por tanto, a posponer la edad a la que cada tipo de daño alcanza la proliferación patogénica. Y puesto que la presión selectiva se impone en esos caminos mediante un mecanismo común, a saber, la relación entre la función de un individuo y su capacidad de contribuir a la generación siguiente, están destinados inexorablemente (excepto en casos especiales que he agrupado bajo el fenómeno de «pleiotropía protagónica») a descender a niveles de eficacia que conducen a las patologías correspondientes a más o menos la misma edad. Así, no existe ninguna posibilidad de conseguir una ralentización sustancial de la acumulación de todos esos tipos de daños perfeccionando un pequeño número de genes. Sin embargo, al igual que ocurre con la medicina geriátrica, la fe en la existencia de una suerte de «panacea» esquiva persiste en la mente de un deprimente número de biólogos.
¿Pero es eso malo? ¿Piensan así los biólogos cuya principal área de estudio es la biología del envejecimiento? No del todo. Sin duda muchos biogerontólogos eligen su área de investigación por motivos que así lo sugieren, pero debemos recordar que, al igual que ocurre en cualquier campo de la ciencia, la mayoría de los investigadores actúan movidos por la curiosidad antes que por el potencial traslacional de sus investigaciones, y no seré yo quien recuerde que la investigación impulsada por la curiosidad carece de valor. Así que no condeno a esos investigadores de la manera en que condeno a la geriatría. Y los biogerontólogos que sí piensan en términos de potencial de aplicación ya admitieron la lógica anteriormente expuesta en la década de 1960 más o menos.
Hasta aquí bien…, en cierto modo. Durante las décadas de 1970 y 1980 todo esto tuvo una desventaja de lo más deprimente. Casi todos los gerontólogos de enfoque traslacional respondieron a esta admisión convirtiéndose en otra clase de gerontólogos, los motivados por la curiosidad, hasta tal punto que se volvió imposible sugerir (ni públicamente, ni en solicitudes de becas, etcétera) la posibilidad de un aplazamiento del envejecimiento sin dañar de forma irreparable la credibilidad de uno. Pero al menos estaban siendo realistas.
Hasta que llegó… el tercer falso amanecer. Por «privación» me refiero, tal y como espero que hayan adivinado, a la restricción calórica (RC), una intervención que ya se demostró en la década de 1930 que alargaba las vidas de ratones y ratas hasta el 50 %. También se reveló que tenía un efecto proporcional (y anatómicamente) mucho más drástico en nematodos, que tienen un desarrollo radicalmente distinto cuando se les priva de alimento en una etapa concreta. Visto en retrospectiva, resulta curioso por tanto que, dados todos estos datos de sobra conocidos, la comunidad biogerontológica se mostrara entonces muy escéptica primero y muy animada después por informes de finales de la década de 1980 y principios de la de 1990 según los cuales el mismo efecto, solo que a una magnitud ligeramente menor, podía conseguirse en nematodos por medios genéticos. Pero con independencia de la historia, el hecho es que el adjetivo «animada» es sin duda un eufemismo.
A día de hoy, la investigación gerontológica biomédica está dominada por la búsqueda de maneras idóneas de emular los efectos de la restricción calórica por medios genéticos o, más recientemente, farmacológicos.
¿Por qué es esto un tercer falso amanecer? Porque salta a la vista que su potencial biomédico verdadero es, y lleva tiempo siéndolo, casi nulo. La razón de que esto sea tan obvio surge de la combinación de dos puntos. Primero, casi sin excepción (la única excepción «conocida» es de hecho probablemente incorrecta, aunque merece investigarse más a fondo), ninguna intervención genética o farmacológica en ninguna especie ha superado nunca el rendimiento de la RC en esa misma especie cuando se ha iniciado a la misma edad (exactamente lo que cabía esperar), puesto que la prolongación de la vida lograda por la RC y su emulación debe estar mediada por los mismos caminos genéticos, unos caminos cuyo efecto es el que es, y punto. Y segundo, el rendimiento de la RC misma varía de forma inversa con la longevidad no relacionada con la RC de la especie: especies más longevas se benefician mucho menos en proporción a su esperanza de vida y, de hecho, no se benefician gran cosa en términos de tiempo absoluto. Esto también era de esperar, puesto que la presión selectiva que da lugar a los caminos que median en la respuesta a la RC surge de la frecuencia de las hambrunas, que es independiente de la longevidad de los organismos que las sufren. Puesto que las hambrunas prolongadas son menos frecuentes que las breves, la predicción está clara. Y si sumamos todas estas cosas, la conclusión también es clara: emular la RC no pospondrá de manera significativa el envejecimiento humano.
¿Pero se deduciría esto de un vistazo a las solicitudes de becas de investigación que subvencionan en la actualidad el Instituto Nacional del Envejecimiento de Estados Unidos o sus homólogos de todo el mundo? Pues no. Si excluimos, tal y como hemos expuesto, las ayudas centradas en ampliar nuestra comprensión del envejecimiento antes que en hacer algo al respecto, la abrumadora mayoría contempla alguna clase de enfoque relacionado con emular la RC. Al igual que con otros amaneceres falsos, hay quienes siguen aferrados a este concepto a pesar de la lógica aplastante que sugiere lo contrario, solo porque sus defensores han incurrido ya en tantos costes en términos de inversión intelectual que su única manera de sobrevivir es continuar aprobándose mutuamente becas de investigación.
La cuarta vía: reparación de daños
En este siglo, a pasos pequeños y con mucho esfuerzo, las cosas están cambiando. En lo que queda de este ensayo describiré los avances a día de hoy a la hora de poner en práctica el enfoque para combatir el envejecimiento que presenté por primera vez hace unos quince años, con el nombre de «Estrategias para una Senescencia Negligible Ingenierizada» (SENS, por sus siglas en inglés). Gran parte de estos progresos se han producido bajo el liderazgo de la organización sin ánimo de lucro creada para este fin, la Fundación de Investigación SENS.
Puede parecer curioso que una organización sin fines de lucro dedicada en parte a mejorar la conciencia pública adopte como nombre una expresión tan técnica como SENS. De hecho, hemos introducido recientemente el término, más claro para los legos, de «biotecnología del rejuvenecimiento» para referirnos a las tecnologías requeridas para implementar SENS. «Rejuvenecimiento», sin embargo, no es un concepto fácilmente cuantificable, y la frase original sigue siendo la descripción más precisa de nuestro objetivo.
«Senescencia» aquí se refiere a un fenómeno actuarial, la tendencia de los individuos de una población a sufrir una tasa creciente de enfermedad y de mortalidad en relación (por lo común exponencial) a su edad cronológica.
«Negligible» se usa en sentido estadístico: consideramos negligible un nivel de senescencia si no se puede demostrar estadísticamente una contribución a la mortalidad relacionada con la edad (como, por ejemplo, encuentros desafortunados con vehículos a motor). Aceptamos que se trata de un blanco móvil; es posible observar un nivel no negligible de senescencia en la misma población después de mejoras en los datos disponibles o en los métodos de análisis, lo que requerirá ulteriores adaptaciones del enfoque terapéutico. De hecho, es probable que esto suceda varias veces.
Por último, con «ingenierizada» queremos indicar que este estado se consigue mediante la aplicación deliberada de terapias biomédicas, y que no es la situación normal (que se observa en, por ejemplo, Hydra, donde la regeneración continuada parece desembocar en una total falta de correlación entre edad y tasa de mortalidad, aunque la preservación indefinida del potencial reproductivo es más controvertida).
Nuestro objetivo está por tanto definido sin ambigüedad posible, ya que buscamos métodos para convertir una población que experimenta un nivel de senescencia no negligible en una que experimenta un nivel negligible.
A la mayoría de los lectores, este objetivo, la eliminación exhaustiva de la degeneración relacionada con la edad, les parecerá disparatado. Sin duda ha sido un logro al que ha aspirado la humanidad al menos desde que tenemos constancia escrita, con escasos resultados. Sin embargo, existen buenas razones para pensar que puede ser algo más fácil de conseguir que una «simple» desaceleración del proceso de envejecer, de manera que el aumento de mortalidad relacionada con la edad descienda y la vida humana se alargue modestamente. En este ensayo describo las razones.
Para entender cómo podría «ingenierizarse» el objetivo de una senescencia negligible es útil considerar una situación en la que el ingenio y la perseverancia humanas hayan alcanzado un resultado análogo. Los vehículos a motor experimentan un proceso de desgaste por el uso similar en esencia al del envejecimiento de los organismos: la pintura se descascarilla, los cristales de las ventanillas se resquebrajan, los conductos se oxidan, etcétera. Sin embargo, como muy bien saben los dueños de coches antiguos, es completamente posible mantener uno operativo, prístino incluso, durante un periodo de tiempo esencialmente indefinido.
Y esto se consigue no previniendo el desgaste —instintivamente podemos saber que hacer algo así de manera perfecta es imposible—, sino reparando el daño producido a un ritmo tal que asegure que el funcionamiento de la máquina no se pone nunca en peligro y nunca de manera irreversible.
Por supuesto, la analogía es inexacta; los cuerpos humanos son mucho más complejos que los coches, y aún estamos muy lejos de comprender cómo están construidos y los procesos que contribuyen a su desgaste. Por suerte, fijarnos con atención en cómo envejecer conduce a la debilidad, revela que nuestra ignorancia no tiene por qué impedirnos actuar.
El envejecimiento puede describirse como un proceso de tres etapas. En la primera, los procesos metabólicos esenciales para la vida producen toxinas, un efecto secundario inevitable de trabajar con sustancias químicas reactivas. En la segunda, una pequeña cantidad del daño producido por esas toxinas no se puede eliminar de los sistemas endógenos de reparación del cuerpo, y por consiguiente se acumula con el paso del tiempo. En la tercera fase, la acumulación de daños causa patologías relacionadas con la edad, ya sea de manera directa —interfiriendo con el metabolismo normal— o indirecta, a menudo donde un proceso de reparación normalmente benévolo causa daños colaterales debidos a una sobreestimulación maladaptativa.
Este modelo («el metabolismo causa daños que causan patologías») nos permite tener bastante más claros los requerimientos para intervenir en el proceso de envejecimiento. A diferencia de los procesos dinámicos de metabolismo y patología —de los que sabemos tan poco, y en los que una intervención desencadena siempre una cascada de repercusiones—, la acumulación de daños constituye un blanco relativamente estable. Esto quiere decir que puede no estar claro si un tipo concreto de daño es patológico (en conjunto), pero su ausencia en un individuo de veinte años indica que no se requiere para una vida sana. A la inversa, está claro que la suma total de tipos de daños sí es patológica, puesto que los individuos de cincuenta años tienen considerablemente menos tiempo por delante que los de veinte, y la única diferencia estática entre los dos grupos es la cantidad de daños acumulados presentes. (Hay diferencias dinámicas, donde el cuerpo reacciona de forma maladaptativa a la presencia de daños, pero la naturaleza profundamente homeostática de la fisiología nos hace pensar que esto se autocorregirá una vez que se elimine el estímulo que causa esa respuesta maladaptativa.)
Aceptar las implicaciones de este modelo (que replica las curvas de mortalidad inducidas por la edad de forma muy prometedora) nos lleva al enfoque SENS; al identificar y reparar todo el daño acumulado durante el envejecimiento, podemos devolver al cuerpo su estado juvenil. En consecuencia, sus procesos metabólicos dinámicos revertirán a su funcionamiento normal y el riesgo de mortalidad no será mayor que el de cualquier otro individuo «joven» equivalente, haya vivido veinte o ciento veinte años. Es más, si nuestro inventario de tipos de daños es lo bastante exhaustivo, podemos repetir este esfuerzo con regularidad y mantenernos indefinidamente por debajo del umbral de la patología. Pero sobre todo podemos hacerlo sin una comprensión exhaustiva de los procesos metabólicos complejos que dan lugar a los daños, ni de los que conducen del daño a la patología. Solo necesitamos un inventario de los tipos de daños que existen, algo que puede obtenerse mediante una comparación entre individuos jóvenes y mayores.
¿Cuáles son los daños asociados al envejecimiento?
Por fortuna, parece que todos los daños relacionados con la edad que se acumulan en el cuerpo humano pueden agruparse en siete categorías bien definidas. Para cada una de ellas, la plataforma SENS incorpora un mecanismo de reparación de daños usando biotecnología existente o prolongaciones fácilmente previsibles de esta. A continuación hago un breve resumen de estas categorías y de las opciones terapéuticas que existen para su resolución:
Pérdida celular
La categoría de daños más clara es la pérdida (muerte irremplazable) de células, ya sea como resultado de lesiones crónicas o de trauma agudo, mediante la apoptosis, por muerte autófaga de las células o por necrosis. Estas muertes conducen a una atrofia de los tejidos que pone en peligro el funcionamiento de los órganos afectados; ejemplos de esto incluyen la enfermedad de Parkinson, la sarcopenia, la diabetes autoinmune y la presbiacusia, y sus tratamientos pasan por la introducción de células madre o progenitoras (o la estimulación de la proliferación de progenitoras endógenas), ya sea de manera sistemática, con la ayuda de mecanismos de selección adecuados, o localmente, mediante ingeniería de tejidos.
Resistencia a la muerte celular
A la inversa, la acumulación de cantidades excesivas de células refractarias a la apoptosis homeostática normal también puede ser dañina. El ejemplo más obvio en el contexto de las sociedades occidentales es la obesidad, pero hay manifestaciones más sutiles: el desequilibrio entre linfocitos T anérgicos y vírgenes que caracteriza la inmunosenescencia es un ejemplo claro. El tratamiento es, en este caso, conceptualmente evidente: identificar biomarcadores que seleccionen las células no deseables y enviar fármacos citotóxicos o virus que aseguren su destrucción.
Exceso de proliferación celular
La última (pero sin duda no la menos importante) categoría «celular» tiene que ver con los daños al ADN genómico, tanto en forma de mutación (cambios en la secuencia de pares de bases) como en «mutación epigenética» (cambios en los segmentos que modifican la molécula de ADN e influyen en su transcripción). Por suerte se trata de un área en la que la evolución nos ha hecho ya casi todo el trabajo duro. Desde la aparición de los vertebrados (al menos), el problema más grave originado por la mutación ha sido el cáncer, que tiene la capacidad de matar un organismo si una única célula adquiere carga mutacional suficiente, mientras que cualquier otra mutación solo se vuelve letal, generalmente, si afecta a una proporción sustancial de las células de un tejido determinado. Los mecanismos de corrección desarrollados para prevenir el cáncer son, por tanto, más que suficientes para mantener las mutaciones no cancerosas bajo control. Así, esta categoría de daños estrictamente molecular se trata mejor, de hecho, como si fuera celular.
Por supuesto que el cáncer en sí continúa siendo un problema muy real. La solución SENS —WILT, un acrónimo de «Whole-body Interdiction of Lengthening of Telomeres» (intercepción del alargamiento de los telómeros en todo el cuerpo)— es la única terapia anticáncer genuinamente universal que se ha propuesto hasta la fecha. WILT es un enfoque doble que incluye el borrado (no la mera inactivación) de la telomerasa y del AAT (alargamiento alternativo de los telómeros; ALT, por sus siglas en inglés) en todo el cuerpo, evitando así que cualquier cáncer de nueva formación crezca lo bastante como para ser mortal, acompañado de un resembrado cada diez años (más o menos) de nuestras reservas de células madre de regeneración rápida de tejidos usando células cuyos telómeros han sido alargados ex vivo. Por ambicioso que esto resulte, la naturaleza exhaustiva de WILT, en caso de que pueda implementarse, no está en duda, de manera que sigue siendo un «tratamiento de último recurso» que no sería inteligente despreciar hasta que se desarrollen terapias más simples de eficacia comparable.
Las cuatro categorías restantes de daño son moleculares antes que celulares; dos son intracelulares y dos extracelulares.
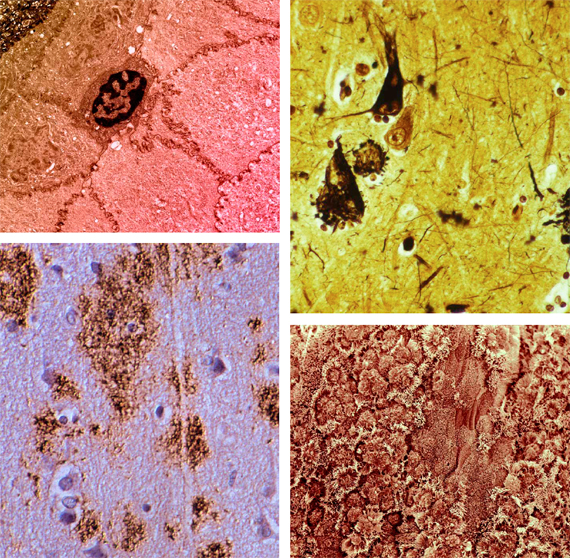
«Basura» intracelular
Aunque los leucocitos son, por lo general, muy eficaces a la hora de detectar (particularmente mediante la respuesta a proteínas desplegadas) y reciclar biomoléculas dañadas o sobrantes, hay algunas excepciones: sustancias que son genuinamente refractarias a la degradación o a la excreción. La acumulación de «basura» resultante afecta al metabolismo de la célula, en el mejor de los casos socavando su funcionamiento normal; en el peor, provocando su muerte. La acumulación de lipoproteínas en placas arterioescleróticas y la fototoxicidad del A2E que produce la degeneración macular seca son dos de los ejemplos mejor estudiados de este mecanismo, que puede tratarse aumentando la maquinaria nativa de degradación introduciendo enzimas nuevas capaces de alcanzar los blancos más recalcitrantes. Estas enzimas tienen que ser introducidas en el lisosoma, «la maquinaria de último recurso de eliminación de residuos».
«Basura» extracelular
No todos los productos de desecho se acumulan dentro de la célula; las tristemente famosas placas amiloides de la enfermedad de Alzheimer, así como los amiloides asociados a la diabetes de tipo II y la amiloidosis sistémica se acumulan en el espacio extracelular. Por fortuna, el cuerpo ya posee un excelente mecanismo para eliminar sustratos no deseados de este compartimento: las células fagocíticas del sistema inmune. Por lo que el problema de la eliminación de la basura se soluciona en esencia desarrollando una vacuna efectiva y segura. (En algunos casos puede ser necesario aplicar los principios de la categoría anterior —la estimulación del lisosoma— para garantizar que las células inmunes sean capaces de degradar por completo las sustancias que consumen.)
Rigidez de los tejidos
Las proteínas comprenden el grueso de la matriz extracelular; en muchos casos estas proteínas se asientan en los primeros años de vida y luego se reciclan muy despacio, si es que se llegan a reciclar, a la edad adulta. La función de los tejidos soportados por estas proteínas —como la elasticidad de la pared arterial— depende de que conserven una estructura molecular adecuada. A medida que pasan los años, esa estructura empieza a peligrar, sobre todo debido al entrecruzamiento inducido por especies reactivas de moléculas, en especial una red de reacciones iniciadas por azúcares en circulación que recibe el nombre colectivo de «glicación». En las arterias, este endurecimiento o rigidez produce presión sanguínea elevada y todas las complicaciones derivadas de esta. Puesto que sucede que estos entrecruzamientos son químicamente distintos de los derivados de enzimas, la estrategia terapéutica es desarrollar fármacos o enzimas capaces de romper estos enlaces cruzados para restaurar la función biofísica original.
Defectos mitocondriales
El ADN mitocondrial (ADNmt) es singularmente vulnerable por estar muy próximo a una intensa fuente de compuestos reactivos (la cadena respiratoria), pero carece de los sofisticados mecanismos de reparación a los que tiene acceso el ADN nuclear. La acumulación de daños en el ADNmt está asociada al envejecimiento, y ligada, tal como cabe esperar cuando un componente celular tan vital está implicado, a una amplia gama de enfermedades degenerativas. Sin embargo, de los cerca de mil componentes proteicos de una mitocondria madura, solo trece están de hecho codificados en el ADNmt, porque los genes restantes se han desplazado, a lo largo de la evolución, al ADN nuclear, desde donde sus productos son translocados eficientemente de vuelta a la mitocondria. La solución en este caso no es reparar los daños de los genes restantes, sino introducir variantes preparadas para la translocación en el genoma nuclear, una técnica llamada expresión alotópica y con la que se obvia el problema de conservar el ADN mitocondrial.
Debemos subrayar que la formulación de estas siete categorías es descriptiva, no prescriptiva. Sin embargo, el hecho de que no se hayan descubierto nuevas categorías de daño celular desde 1982, a pesar de lo espectacular del progreso en técnicas bioanalíticas, sugiere que las otras categorías se acumulan demasiado despacio como para tener un impacto en la salud dentro del marco temporal de la vida humana.
Progresos recientes
Desde que se propuso el primer enfoque SENS, en 2002, se han hecho progresos notables en todas las principales áreas de investigación. En lo que queda de capítulo resumiré algunos de los hallazgos más apasionantes y recientes, y explicaré cómo contribuyen al desarrollo de biotecnologías de rejuvenecimiento efectivas.
Por qué reciclar salvará algo más que al planeta
Algunos de los indicios recientes más prometedores a favor de una estrategia basada en la eliminación de daños acumulados proceden de experimentos con la autofagia, el proceso por el
cual las células reciclan de forma natural proteínas, lípidos e incluso orgánulos enteros. En concreto, se ha demostrado que la autofagia mediada por carabinas (AMC), un proceso que media en la translocación de proteínas portadoras de un patrón específico al lisosoma (ya sea de manera inherente o como consecuencia del despliegue o de una modificación postraslacional para su degradación), disminuye con la edad debido a la presencia menor del receptor de Lamp–2A (membrana proteínica asociada allisosoma).
Ratones modificados con Lamp-2A inducible en el hígado (donde la disfunción autófaga relacionada con la edad está bien definida) muestran niveles marcadamente bajos de acumulación de proteínas oxidadas y degeneración estructural a los veintidós meses, con una función hepática más próxima a la de un ratón joven (de seis meses) que a sus compañeros de camada usados como control. Sorprendentemente, los ratones transgénicos también mostraron tasas aumentadas de macroautofagia y de la actividad ubiquitina-proteasoma, lo que implica que se da un proceso de retroalimentación positiva entre sistemas de reparación de daño celular.
Reforzar el tráfico de biomoléculas dañadas es, por supuesto, solo una de las maneras de aumentar su tasa de reciclaje. En un trabajo muy reciente con ratones modelo para la enfermedad de Alzheimer, la desinhibición de la proteasa lisosomal catepsina B ha dado como resultado una eliminación drástica de Aβ (1-42), seguida de una recuperación sustancial de déficits conductuales en múltiples test.
Herramientas, prestadas y encontradas
Por prometedores que sean los enfoques basados en reforzar la maquinaria de reciclado ya existente, hay algunos productos de desecho relacionados con la edad que parecen por completo refractarios a la degradación por parte de las enzimas líticas normales de la célula. Estos blancos de actuación —incluido el bisretinoide tóxico A2E, algunas formas de colesterol oxidado y otras— requieren un método de eliminación cualitativamente distinto.
Una de las primeras cosas observadas en el plataforma SENS fue que muchas de estas sustancias, si bien resistentes a la degradación por parte de células humanas, no se acumulan ni siquiera en suelos altamente enriquecidos con restos humanos. Por tanto, se razonó que debe de existir algún organismo que sea competente a la hora de metabolizarlas. Pronto se identificaron especies bacterianas con estas capacidades, y el proceso de determinar las enzimas implicadas y adaptarlas a formatos de uso terapéutico es una de las grandes ramas de investigación en las que se trabaja actualmente en el Centro de Investigación de la Fundación SENS.
Uno de los avances más recientes ha sido el descubrimiento de anticuerpos catalíticos (aquellos con una actividad hidrolítica directa contra un antígeno particular supuestamente debido a una afinidad mayor con el estado de transición que con el estado fundamental) que actúen contra el amiloide-β. La inmunoterapia directa contra el depósito amiloide supone siempre un escollo durante los ensayos clínicos debido a los efectos secundarios dañinos de inflamación cerebral, un problema especialmente pronunciado en pacientes con enfermedades avanzadas, y por consiguiente con una carga amiloide alta. La inmunoterapia catalítica, por otra parte, evita este escollo, porque la proteína hidrolizada no es secuestrada en una forma proclive a generar una respuesta inmune. Al mismo tiempo, gracias a la alta especificidad del anticuerpo, la estrategia evita los efectos no buscados que se observan con enfoques que tratan hidrólisis amiloide con enzimas convencionales (como la neprilisina).
El mecanismo por el cual los anticuerpos terapéuticos de cualquier tipo atraviesan la barrera hematoencefálica es un campo objeto de activa investigación. Aunque la penetrancia de la inmunoglobulina de clase C (IgC) es muy baja, se ha comprobado que la IgM y los fragmentos FAB traspasan la barrera de forma mucho más efectiva, y, en cualquier caso, siempre se podría ayudar a entrar a un agente de baja penetrancia, pero por lo demás efectivo, manipulando el proceso del transporte mediado por receptor que emplean sustancias como la insulina y la transferrina.
La fundación SENS está patrocinando un proyecto para determinar si puede aplicarse de manera efectiva la tecnología de anticuerpos catalíticos a la amiloidosis cardiaca, que afecta la función cardiaca de hasta el 25 % de personas mayores de ochenta años y parece ser la causa de muerte más común en las edades más avanzadas.
Cuando no provee la naturaleza
A la hora de tratar sustancias de desecho recalcitrantes, o enlaces cruzados de proteínas de la matriz extracelular, el desafío es, por lo general, identificar una enzima (o molécula pequeña) capaz de transformar la degradación de una especie particular en una más susceptible a la maquinaria de reciclaje natural del cuerpo. El criterio de referencia para lograr este objetivo dentro de la industria farmacéutica es el cribado farmacológico de amplio rendimiento, que consiste en testar enormes selecciones de candidatos con la esperanza de identificar uno o más con la actividad buscada.
Por muy efectivos que puedan resultar, los cribados de alto rendimiento son, en esencia, una lotería bioquímica. En consecuencia, en ocasiones se argumenta que pueden existir tipos de daño de difícil tratamiento porque el agente requerido para repararlos está ausente de todas las bases de datos de estructuras químicas o quimiotecas, o bien nunca ha sido sintetizado. ¿Supone esto un problema para la exhaustividad del enfoque SENS?
Aunque esta área de investigación está dando aún sus primeros pasos, el diseño por ordenador (y optimización por evolución dirigida) de enzimas capaces de catalizar una reacción arbitraria por órdenes de magnitud múltiples ha demostrado recientemente ser factible. Las aplicaciones de este enfoque en la industria —por no hablar de la medicina— son tan evidentes que su perfeccionamiento parece inevitable. Por tanto, confiamos en que ninguna forma específica de daño químico sea irreparable para siempre.
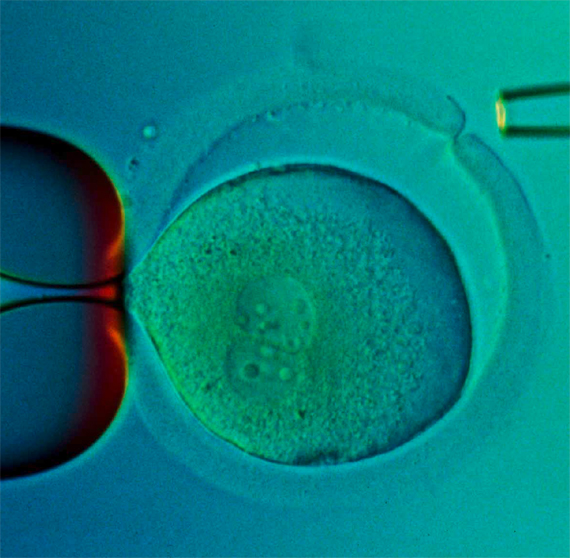
Partes sueltas y corazones por encargo
Aunque la reparación in situ a nivel celular y molecular es la solución más idónea para los daños relacionados con la edad, no creemos que vaya a ser siempre viable, sobre todo mientras la biotecnología de rejuvenecimiento continúe en pañales. En algunos casos, los daños serán demasiado grandes y heterogéneos para que su reparación sea factible; en otros, la naturaleza molecular exacta del daño puede ser demasiado confusa para que se pueda formular un ataque directo.
Para estos casos existe una solución temporal que debemos buscar en el campo de la ingeniería de tejidos: en lugar de rejuvenecer el órgano existente, trataríamos de reemplazarlo con uno completamente nuevo desarrollado in vitro. Este concepto no tiene nada de novedoso, pero se ha enfrentado a tres grandes impedimentos: en primer lugar, el problema de conseguir una vascularización adecuada para el tejido cultivado; en segundo (y en particular cuando reemplazar el órgano es urgente, como suele ser el caso), los periodos prolongados de crecimiento proliferativo necesarios para alcanzar el tamaño y la funcionalidad de un órgano adulto; y en tercero, la necesidad, cuando se usan células alogénicas o tejido, de tratar al paciente con inmunosupresión de por vida.
Hay dos métodos nuevos de síntesis de órganos que se muestran prometedores a la hora de superar estas limitaciones. En el primero —la descelularización—, se trata tejido de un donante con una mezcla de detergente y enzima hasta que las células originales y los antígenos del donante desaparecen y dejan un andamiaje vacío y no inmunogénico.
Este andamiaje a continuación se incuba durante varios días con células madre/progenitoras del paciente, que lo repueblan y con el tiempo reconstituyen las funciones normales del tejido. Cosa importante, aunque la fase de preparación del andamiaje requiere semanas, puede llevarse a cabo sin conocimiento del receptor; solo la fase, mucho más breve, de repoblación, es específica para cada paciente. Con éxito demostrado hasta el momento en un injerto traqueal de gran envergadura, todo apunta a que el uso de esta técnica se extenderá en un futuro cercano.
La segunda técnica novedosa es la bioimpresión, que consiste en preparar un injerto de casi cualquier forma que se desee depositando células de manera similar al funcionamiento de una impresora de chorro de tinta. La bioimpresión elimina la necesidad de un soporte de donante, y por tanto podría resultar con el tiempo ser más práctica para un uso general. Aunque su aplicación terapéutica está en una fase muy temprana, la perspectiva de un suministro casi ilimitado de órganos altamente similares, ideal para conducir ensayos clínicos en condiciones de seguridad, está atrayendo sustanciales inversiones preclínicas.
Un gramo de prevención
Ya hemos presentado el concepto de expresión alotópica, es decir, transferir los trece genes codificantes de proteína del ADNmt al genoma nuclear, donde se beneficiarán de mecanismos de conservación mejores y de aislamiento de las fuentes más peligrosas de sustancias reactivas. Por supuesto, la descripción más bien concisa que hemos ofrecido solo describe de manera superficial las dificultades técnicas que lleva aparejadas.
Las proteínas en cuestión figuran entre las más hidrófobas de las encontradas en la mitocondria; en consecuencia, una vez plegadas después de la síntesis en el citoplasma, son las más difíciles de desplegar otra vez, un requisito previo a su translocación al otro lado de la membrana mitocondrial interior. Cuando se presentó SENS, se sugirieron dos estrategias complementarias para facilitar la importación. La primera fue la sustitución de residuos aminoácidos altamente hidrófobos por análogos menos hidrófobos; la segunda incluía la introducción de inteínas autoescindibles en las regiones de plegado más firme, evitando que se plieguen por completo hasta después de la translocación. Por supuesto, la primera estrategia tenía probabilidades preocupantemente altas de dañar el funcionamiento de la proteína (incluso con mutaciones puntuales que se sabía que no eran patógenas si se empleaban de forma aislada), y la segunda dependía de biotecnologías nuevas y en su mayor parte sin testar.
En 2006, un grupo francés que trabajaba con mitocondriopatías hereditarias demostró que, introduciendo una secuencia de acceso en la región 3’ no transcrita del ARN mensajero para la ATP6 (una subunidad del complejo ATP sintasa y una de las trece proteínas codificantes del ADNmt), era posible restringir el ARN mensajero a la superficie mitocondrial. La restricción conseguida, de hecho, es tan intensa, que la importación se vuelve «co-traslacional»: la cadena de aminoácidos se nutre mediante la maquinaria importada al ser sintetizada, antes de plegarse, obviando así el problema de su hidrofobia. Más adelante, el mecanismo demostró ser efectivo para los genes ND1 y ND4. Con la aprobación de los creadores de la técnica (que están trabajando en la aplicación clínica de sus resultados originales), personal del SENS Research Center trabaja para confirmar si es posible aplicar la misma metodología a las diez proteínas codificantes del ADNmt restantes.
Conclusión
SENS supone un alejamiento muy radical de las prioridades anteriores de la gerontología biomédica y busca revertir de verdad el envejecimiento en lugar de simplemente aplazarlo. Gracias a un minucioso proceso de educación mutua entre los campos de la biogerontología y la medicina regenerativa, ahora ha alcanzado el estatus de opción viable y reconocida para un futuro control médico del envejecimiento. Mi opinión es que su credibilidad seguirá aumentando a medida que progrese la tecnología de medicina regenerativa subyacente.
Comentarios sobre esta publicación